QUÍMICA 11
HILO CONDUCTOR
¿Por qué el átomo de carbono es el
centro de la química orgánica?
TÓPICO GENERATIVO
Las Semillas de la Vida
-historia de la química orgánica
-estructura e hibridación del átomo de
carbono
-nomenclatura, propiedades y
reacciones: hidrocarburos, aldehídos y cetonas
META ESPECÍFICA
El estudiante comprenderá la
importancia del átomo de carbono y la forma en que se enlaza para formar
diferentes funciones orgánicas.
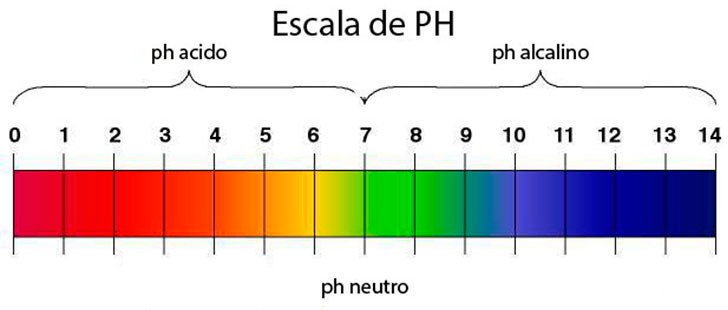
ESCALA DE pH Y pOH
Definimos pH como: pH= -log (H+)
Definimos
pOH como: pOH= -log (OH-)
Por lo tanto el pH dependerá de la
concentración de iones hidrogeno y el pOH de la concentración de iones
hidroxilo. Teniendo las concentraciones de estos iones podemos hallar sus
valores (en la anterior temática se vio como calcular estas concentraciones).
Ejemplo del cálculo de pH: determinar el pH
de una disolución de HCl 0,5M
Solución: como vimos anteriormente la
concentración de los iones hidroxilo será la misma concentración del ácido
según su estequiometria.
Según
la definición de pH: (H+) = 5X10-3M
pH= -log (H+)
Remplazamos
la concentración de iones hidrogeno: pH= -log(5x10-3)=2.30
Imagen tomada de: https://www.experimentoscientificos.es/ph/escala-del-ph/
Si
analizamos el resultado anterior
es un pH acido por ser el HCl un
ácido fuerte.
Ahora bien si trabajamos con una sustancia básica,
no podremos hallar el pH de manera directa, tenemos que hallar en primera
medida el valor de pOH y después si hallar el pH por medio de la siguiente
relación entre pH y POH que se da a una temperatura de 25°C:
|
En toda sustancia la sumatoria del valor de pH y pOH siempre
será 14 a 25°C
Veamos
un ejemplo de esto:
Calcule
el pH y POH de una disolución de KOH 3x10-5 M a 25|C
Sabemos que: : (OH-)= 3X10-7 M
Como
ya habíamos dicho antes al tratarse de una base no determinamos de manera
directa el pH, hallaremos primero el valor de pOH.
pOH= -log (OH-) = -log (3X10-3) = 4.52
Hallamos el pH: pH+ pOH = 14
14-4.52= 9.48
SOLUCIÓN: pH= 9.48 y pOH= 4.52
TALLER pH y pOH
1. Complete la siguiente tabla. Realizando los respectivos cálculos
EVALUCIÒN DE CONOCIMIENTOS
1. Realizar la fase de síntesis presentada en el modulo I periodo.
|
No hay comentarios.:
Publicar un comentario